蛋白质糖基化是一类广泛存在于中枢神经系统的翻译后修饰,糖基化修饰过程易受到疾病干扰而发生改变,异常糖基化则会影响疾病的发生发展。乙肝导致肝硬化肝癌等终末期肝病常常合并肝性脑病,氨中毒学说为其主要发病机制之一,但氨毒性与脑部蛋白质糖基化异常之间的关联性仍不清楚。西北大学生命科学学院功能糖组学实验室李铮教授团队揭示了乙肝相关肝病发生发展过程中氨与脑部蛋白质糖基化异常的分子机制,相关研究结果于近日发表于Cell & Bioscience,我校为第一署名单位和通讯单位。

肝性脑病是乙肝导致肝硬化肝癌等终末期肝病患者常见的并发症,高浓度氨是伴随其发生发展的最典型神经毒素,系统全面的揭示氨毒性与肝性脑病的分子机制有望为其早期诊断及治疗提供理论参考。蛋白质糖基化修饰广泛参与大脑发育、神经退行性疾病及脑癌等过程,而糖基化的酶促反应由糖基转移酶和糖苷酶控制,酶的异常导致特异性糖基化发生,并与多种生物学过程和疾病进程相互影响。目前,虽然氨被认为是肝性脑病发生时最重要的神经毒素,但其与异常蛋白质糖基化之间的潜在病理生理机制尚不清楚。
李铮教授团队以HBV转基因小鼠及人脑星形胶质细胞系为研究对象,探究HBV转基因小鼠慢性肝病发生发展过程伴随的脑部变化,并利用凝集素芯片技术分析HBV转基因小鼠与对照小鼠脑部糖蛋白糖链谱,初步筛选与慢性肝病相关的脑部异常糖蛋白糖链;随后结合体外实验模拟高氨浓度环境,揭示脑部异常糖蛋白糖链与氨毒性的关联性,并分析此过程中特异性糖基转移酶的变化。另一方面,利用基因表达干扰技术分析糖基转移酶基因对星形胶质细胞功能的影响,并结合逆转实验研究参与其中的关键调控分子。
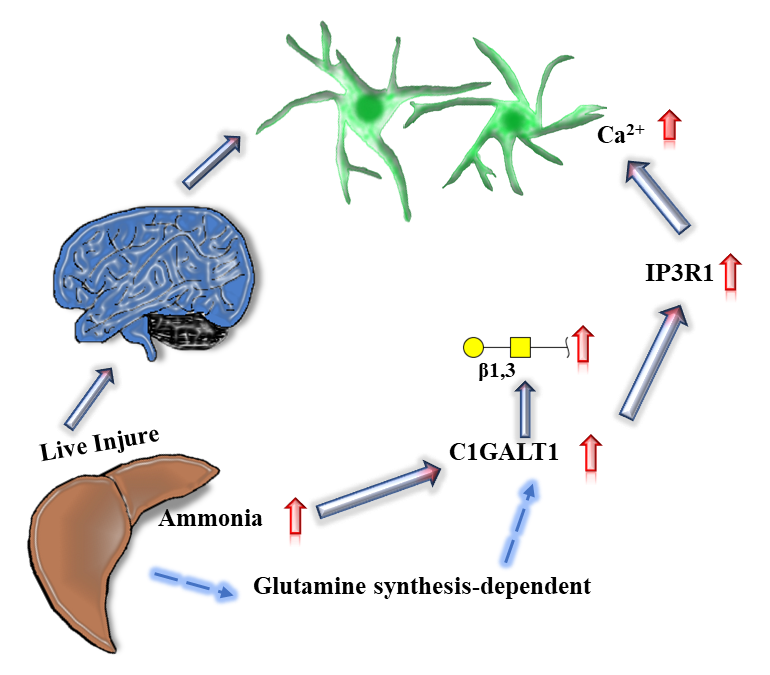
研究结果显示,在HBV转基因小鼠慢性肝病的发生发展过程中,其脑组织糖蛋白糖链谱发生了显著变化。其中,氨作为肝性脑病发生时最重要的神经毒素,显著影响了星形胶质细胞糖蛋白中Galβ1-3GalNAc的表达,编码该糖链的核心1 β1,3-半乳糖基转移酶 (Core 1 β1,3-galactosyltransferase, C1GALT1) 在星形胶质细胞中表达升高是引起其上调的主要原因。此外,氨通过诱导C1GALT1表达而调节肌醇1,4,5-三磷酸受体-1 (Inositol 1,4,5-trisphosphate receptor type 1, IP3R1),进而影响星形胶质细胞内钙稳态,而IP3R1激动剂可有效恢复由C1GALT1引起的胞内钙稳态失调 (图1)。因此,C1GALT1和IP3R1有望作为肝性脑病发生时由氨毒性引起的神经功能失调的治疗靶点。