近日,西北大学生命科学与医学部李想教授团队在MDS克隆细胞中TWIST1影响间充质干细胞分化重编程的分子机制的研究中取得了新进展,研究结果分别发表在《Redox Biology》杂志(中科院一区TOP期刊,IF=11.4)以及《Cell communication and signaling》杂志(中科院二区期刊,IF=8.4)。
骨髓来源的间充质干细胞(Bone marrow mesenchymal stem cells, BMMSCs)是骨髓微环境的重要组成部分,具有分化为成骨细胞和脂肪细胞的潜力,并且与骨髓增生异常综合征(Myelodysplastic syndromes, MDS)和急性髓系白血病(Acute myeloid leukemia, AML)等髓系恶性肿瘤的疾病进展密切相关。而在MDS及AML中通常伴随着BMMSCs分化能力的改变,而具体机制还尚不清楚。
TWIST1是一种具有碱性螺旋环结构转录因子,能够结合在特定的E-box序列上调控下游基因的转录。在本实验室的前期研究中发现TWIST1在高危MDS以及对去甲基化治疗耐受的MDS病人中表达异常升高,这也预示着TWIST1在MDS的疾病进程中具有关键作用。但是TWIST1在MDS中异常高表达的分子机制以及TWIST1在骨髓微环境中的作用还鲜有报道。

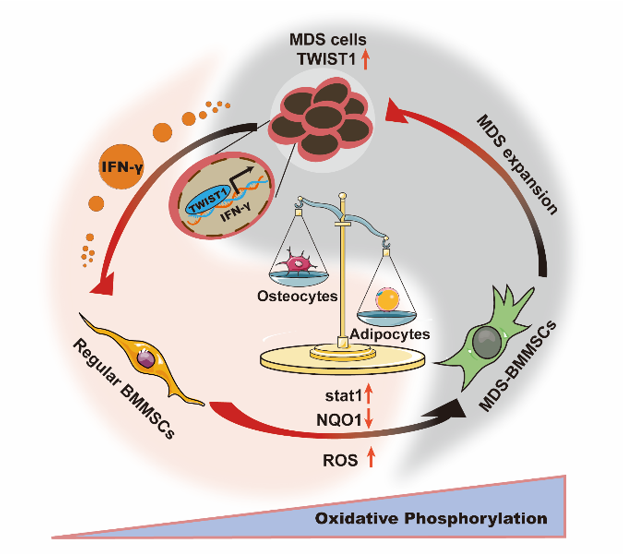
该研究发现MDS/AML恶性克隆细胞能够促进BMMSCs的成脂分化、抑制成骨分化,从而促进MDS克隆细胞的扩增。本文通过临床样本,利用细胞模型和小鼠模型发现MDS/AML细胞中高表达的转录因子TWIST1在介导BMMSCs分化重编程中起着至关重要的作用。TWIST1可诱导MDS/AML细胞分泌更多IFN-γ,而IFN-γ可通过激活Stat1信号通路抑制活性氧清除剂NQO1的表达,增高BMMSCs中活性氧含量,最终导致BMMSCs成脂分化能力增强,成骨分化能力减弱。使用Stat1信号通路抑制剂fludarbine和活性氧清除剂NAC可以逆转由MDS克隆细胞导致的BMMSCs的分化重编程,抑制促癌骨髓微环境的形成。此研究详细阐述了MDS克隆细胞中TWIST1影响BMMSCs分化重编程的机制,将为后续通过靶向恶性克隆细胞中的驱动癌基因,如TWIST1,重塑周围骨髓微环境,为治疗MDS/AML和其他造血恶性肿瘤提供新的治疗策略。该研究成果以 “Clonal MDS/AML cells with enhanced TWIST1 expression reprogram the differentiation of bone marrow MSCs”为题发表在Redox Biology期刊,西北大学生科院博士后李鸿姣和陕西省人民医院血液科王一主任为共同第一作者,李想教授为通讯作者。

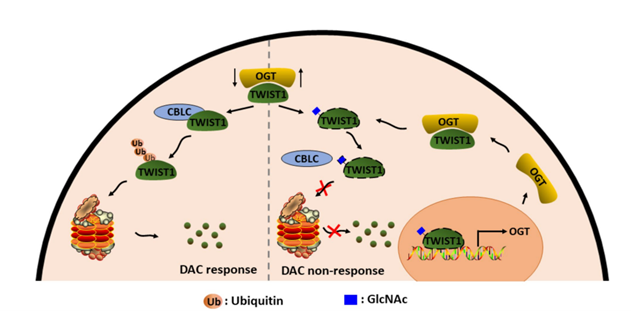
另一方面,该研究从蛋白质翻译后修饰的角度阐述了TWIST1在MDS中表达异常升高的机制,发现转录因子TWIST1蛋白上的31位丝氨酸上存在O-GlcNAc修饰,并且该修饰可以抑制TWIST1与E3泛素连接酶CBLC的互作,进而抑制TWIST1发生泛素化修饰,稳定TWIST1的表达,通过染色质共沉淀和双荧光素酶报告基因实验,发现TWIST1可以结合OGT启动子区,激活OGT转录。该研究成果以“Reciprocal regulation of TWIST1 and OGT determines the decitabine efficacy in MDS/AML”为题发表在Cell Communication and Signaling期刊,西北大学生科院博士后李鸿姣和陕西省人民医院血液科王一主任为共同第一作者,李想教授和关锋教授为共同通讯作者。
李想教授课题组长期关注TWIST1在MDS中的生物学功能,发现TWIST1基因的异常表达与MDS的疾病进程及去甲基化治疗耐受密切相关。在前期的工作中发现TWIST1在高危MDS及地西他滨耐受的MDS患者中表达显著升高,TWIST1能够与甲基转移酶3a形成复合体,共同参与下游靶基因启动子区甲基化,进而引起MDS克隆细胞对去甲基化治疗的耐受的机制(Blood,2010;Haematologica,2013&2019)。此次,李想教授团队从恶性克隆及骨髓微环境方面探究 TWIST1在MDS这种的关键作用,将为MDS的诊疗提供新的思路。
本研究受到国家自然科学基金,陕西省杰出青年科学基金,陕西省创新团队,陕西省高校青年创新团队等项目支持。
文章全文链接
DOI:10.1016/j.redox.2023.102900;DOI:10.1186/s12964-023-01278-y