干细胞自我更新与分化的精准调控,是维持组织稳态和实现再生的核心环节。RNA的m6A修饰作为一种关键的表观转录调控机制,在干细胞命运决定中扮演重要角色,但其在再生过程中的具体作用路径尚未完全阐明。
近日,西北大学陈富林、余源课题组在Journal of Advanced Research上在线发表了题为RNA m6A-binding protein YTHDF2 regulates neoblast proliferation in planarian regeneration by targeting ASTACIN Signaling的研究论文。该研究聚焦于m6A结合蛋白YTHDF2在涡虫再生中的功能,系统揭示了其通过降解特定靶基因维持干细胞池的新机制,为理解组织再生和干细胞调控提供了新视角。
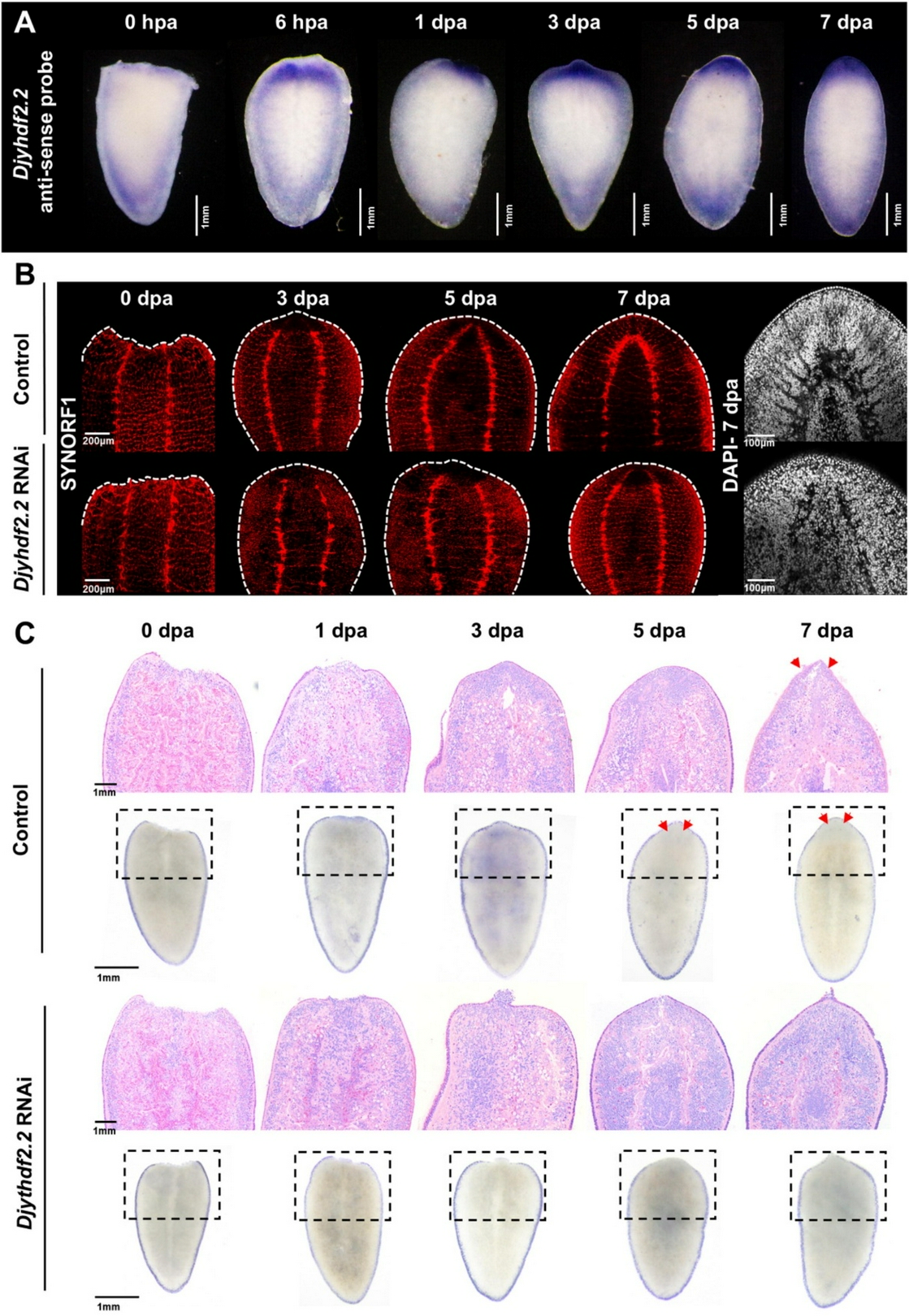
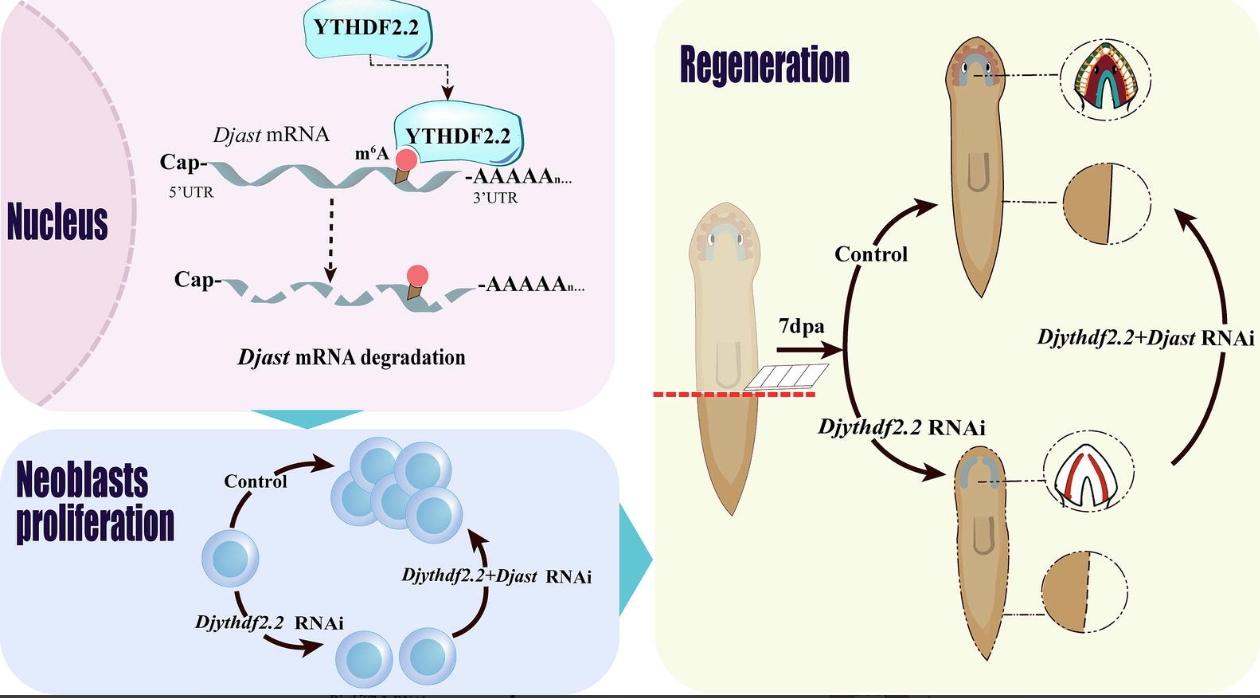
研究发现,涡虫被截断后,ythdf2.2表达显著上调;敲低该基因会导致再生芽基形成缺陷、眼点再生失败,并破坏组织稳态。通过整合MeRIP-seq与RNA-seq技术,研究团队鉴定出金属内肽酶基因astacin是YTHDF2.2的关键m6A修饰靶标。YTHDF2.2能够识别astacin mRNA上的m6A修饰并促进其降解。当YTHDF2.2被敲低后,astacin mRNA稳定性异常升高、大量积累,进而抑制干细胞增殖、增加细胞凋亡,最终导致再生障碍。而同时敲低ythdf2.2与astacin,则可显著恢复干细胞增殖能力与涡虫的再生表型。
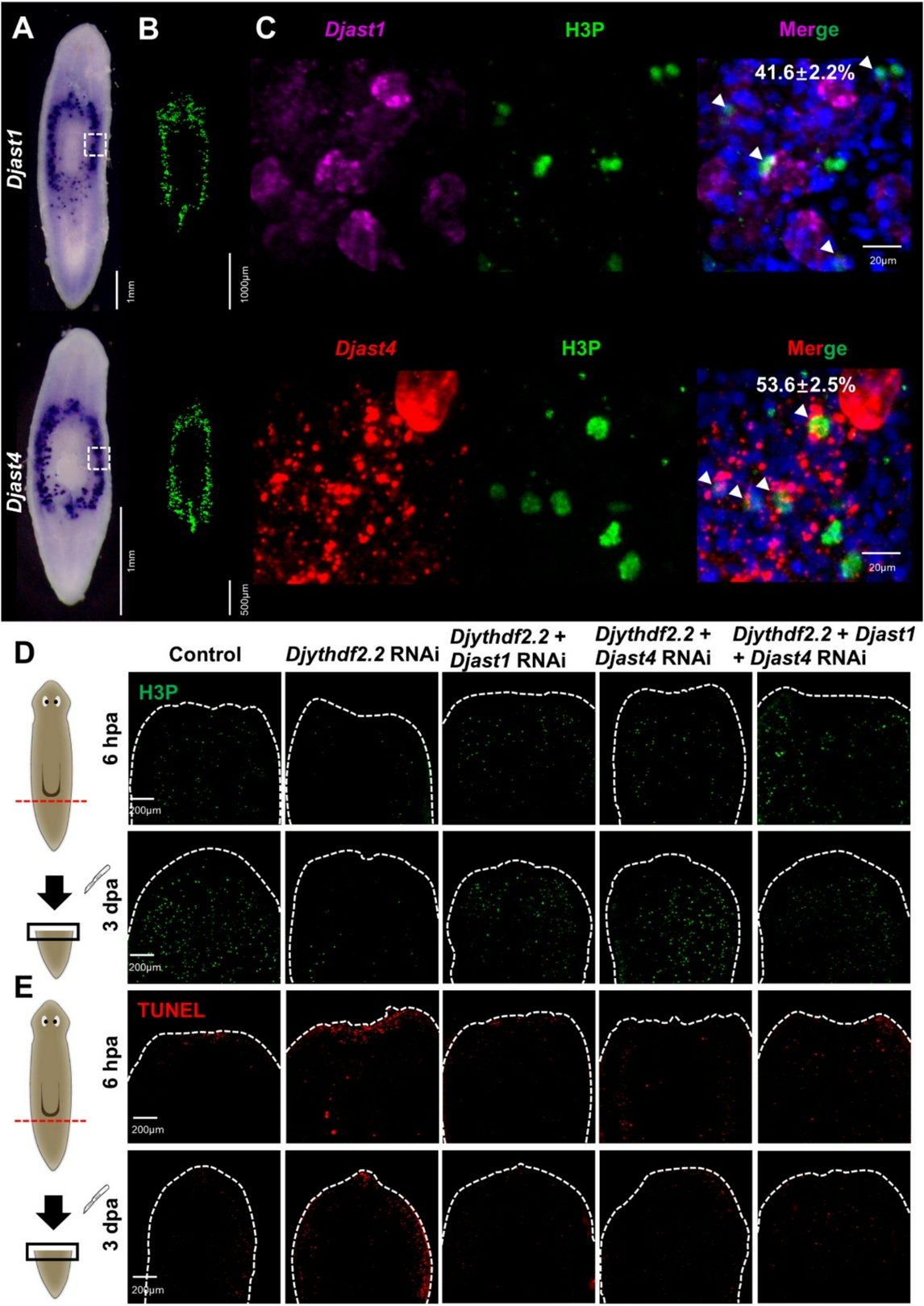
该研究首次在涡虫中解析了“YTHDF2–m6A–astacin”这一转录后调控轴,阐明m6A阅读蛋白通过调控靶基因mRNA稳定性来精确控制干细胞行为与组织再生的分子机制。这不仅深化了对干细胞生物学及再生过程中表观转录调控的理解,也为探索高等动物的再生潜能提供了新的理论依据和潜在调控靶点。
西北大学陈富林教授、余源副教授为该论文的共同通讯作者,西北大学博士后郑晗雪、博士生王都为共同第一作者。西湖大学雷凯教授为文章提供大量建设性的意见和建议。
原文链接: