2020年2月24日,我院西部资源生物与现代生物技术教育部重点实验室梁海华教授团队在EMBO J上发文:The SiaA/B/C/D signaling network regulates biofilm formation in Pseudomonas aeruginosa,研究揭示了铜绿假单胞菌生物被膜形成的信号通路,及其调控过程。
本研究对siaABCD操纵子的具体功能及这四个基因之间的关系进行了深入的研究:发现siaABCD操纵子编码一个信号系统,通过调节SiaD合成酶的活性控制细菌中胞内c-di-GMP的水平,进而调控细菌生物被膜形成和聚集现象。遗传学表型研究表明SiaA/C/D正调控,而SiaB负调控细菌聚集以及生物被膜的形成。此外,SiaC蛋白在这一调控系统中处于中心位置,是该系统的关键“开关”。SiaA及SiaB位于SiaC上游,而SiaD位于SiaC下游。首先,单独的SiaD几乎不具有合成c-di-GMP的活性;而SiaC是合成酶SiaD的结合伴侣,通过直接结合,激活SiaD的酶活性。其次,SiaC与SiaB,SiaC与SiaA之间亦可直接结合。
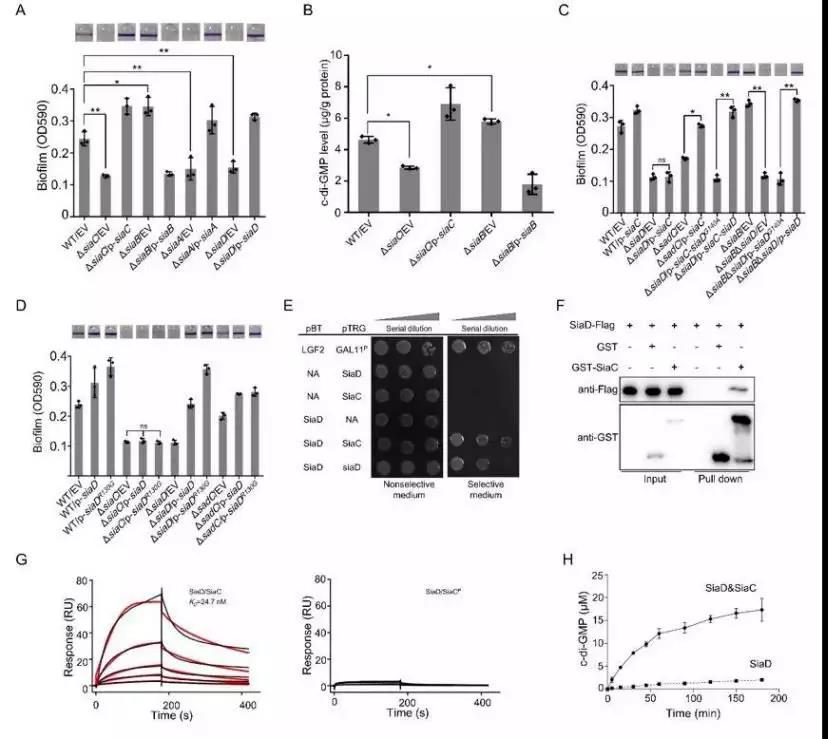
图1. SiaC激活SiaD酶活性。(A-D),生物被膜型研究表明SiaD依赖于SiaC发挥功能。细菌双杂交(E)、GSTpull down(E)以及SPR(E)分析表明SiaC与SiaD蛋白直接结合。(H)体外酶活实验表明SiaC通过与SiaD结合,激活SiaD合成酶活性。
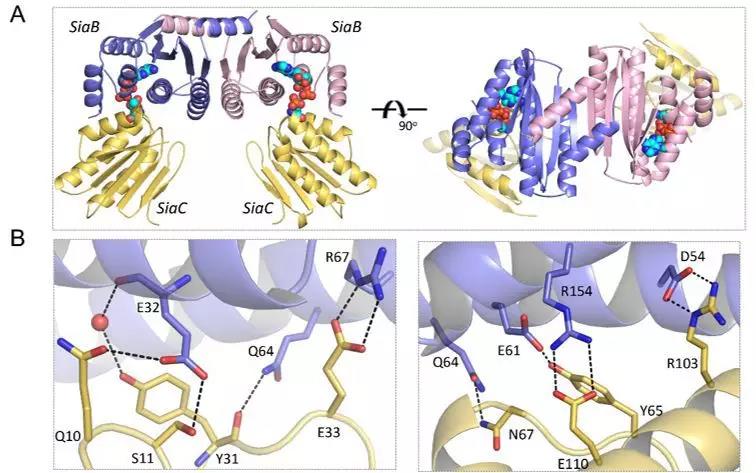
团队进一步地对SiaA和SiaB蛋白的功能进行了研究。利用P32放射性标记分析以及蛋白质质谱分析,证明了SiaB是一种新的激酶,可特异地磷酸化SiaC蛋白的第68位苏氨酸,而磷酸酶SiaA可特异地去除该位点的磷酸基团。SiaC单独蛋白以及SiaC-SiaD-ADP复合物的三维晶体结构的解析,清楚地阐述了SiaB的催化机制。
图2. SiaB-SiaC-ADP复合物晶体结构。(A)SiaC-SiaB-ADP复合物三给晶体结构;(B)SiaB-SiaC相互作用表面。
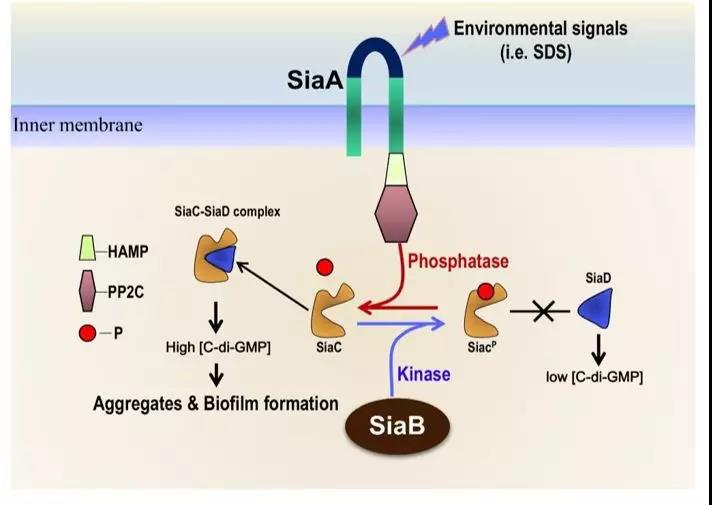
总结来说,如下图所示,细菌会影响胞外环境的变化,通过SiaA及SiaB调节SiaC蛋白的磷酸化状态:当SiaC被磷酸化,其不与SiaD结合,胞内c-di-GMP水平较低;而当SiaC处于非磷酸化状态时,其结合并激活SiaD,细菌大量合成c-di-GMP.因此SiaC蛋白的磷酸化状态对于其与SiaD蛋白质的相互作用至关重要,是直接控制SiaD合成酶活性的“开关”。综上所述,本研究揭示了与急-慢性感染相关的DGC合成酶酶活性调控的分子机制,为开发针对性的抗性菌药物提供了理论基础。
图3. 铜绿假单胞菌SiaABCD信号系统调控生物被膜及细菌聚集分子机制。一般条件下(如丰富培养基),激酶SiaB发挥主要作用,催化SiaC磷酸化,阻止SiaC与SiaD结合进而激活其c-di-GMP合成酶活性。因此,低水平的胞内c-di-GMP不足以促进生物被膜及细菌聚集的形成。当细菌遭遇环境压力时(如SDS刺激),SiaA磷酸酶活性被激活,去磷酸化SiaC蛋白,促进SiaC-SiaD蛋白结合,激活SiaD合成酶活性。此时,高水平的胞内c-di-GMP激活生物被膜及细菌聚集形成。
原文链接:
https://www.embopress.org/doi/epdf/10.15252/embj.2019103412